免疫疗法下一站:CCR8
当前肿瘤免疫治疗难点之一是消除肿瘤微环境(TME)中调节性T细胞(Treg)的免疫抑制效应,以增强特异性抗肿瘤应答。今年5月,BMS一款靶向CCR8的单克隆抗体正式启动了一项新的临床I/II期试验,以评估与O药联用对抗多种实体瘤的效果,这是目前为止全球第一个启动临床研究的靶向CCR8单抗药。人类肿瘤中Treg的存在与免疫治疗的抗药性有关,在动物研究中已经证明,阻断CCR8可以加强对肿瘤生长的抑制,因此开发CCR8靶向性药物有望特异性地抑制肿瘤部位Treg细胞的功能,有助于癌症治疗。
“
CCR8“何许人”
CCR8是高表达于Treg、Th2等细胞表面的趋化因子受体,属于A类G蛋白偶联受体,七次跨膜,在外周血和正常组织细胞上基本不表达,但在肿瘤浸润Treg细胞表面表达上调。CCR8也是一种免疫抑制性受体,介导了肿瘤细胞的免疫逃逸。
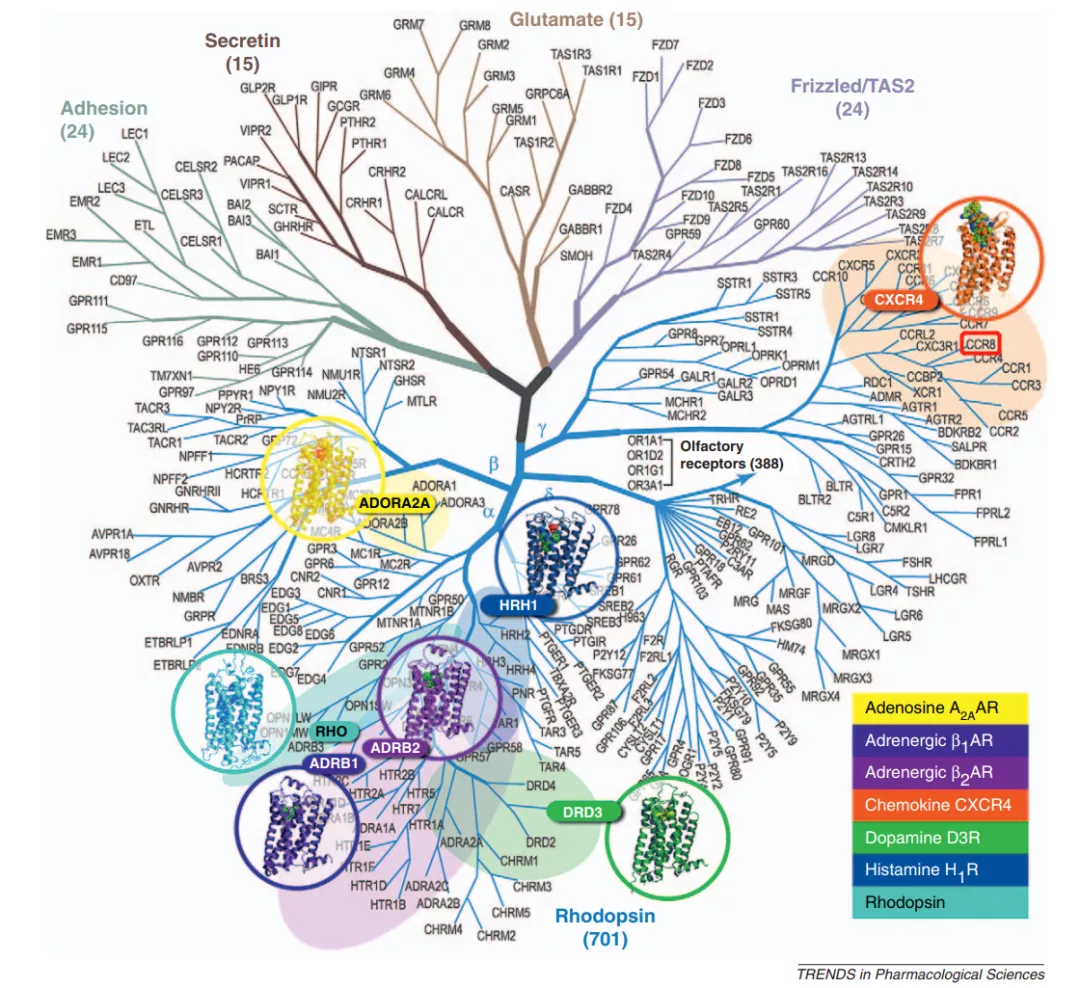
CCR8所属的GPCR超家族进化树 [1]
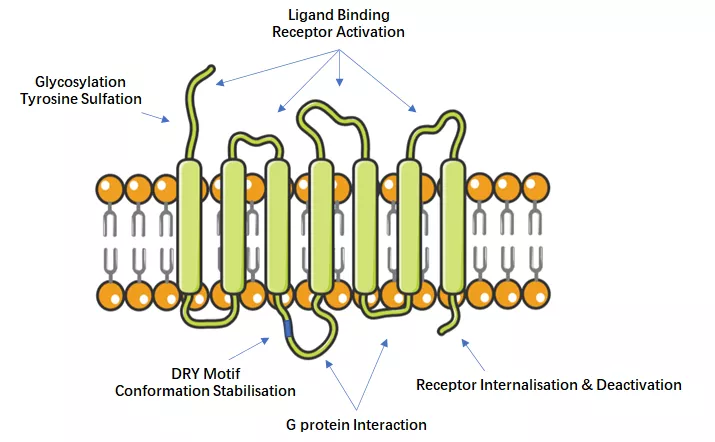
CCR8结构图 [2]
CCR8的配体有CCL1、CCL8、CCL16、CCL18,其中CCL1是其主要配体,且CCR8是目前已知CCL1的唯一受体,另外,CCL1和CCR8在多种肿瘤及炎症位置均显著高表达。
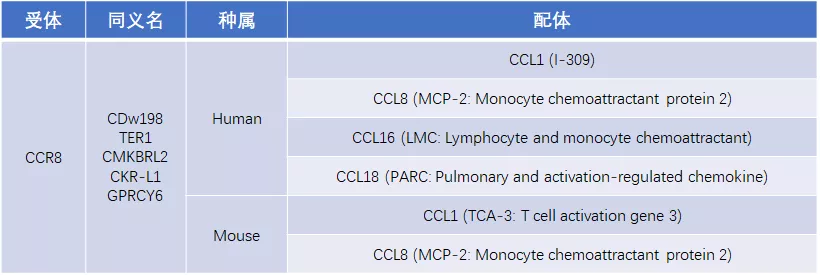
CCR8及其配体
CCR8与其配体的相互作用参与了多种肿瘤的发展进程以及介导了肿瘤的免疫系统攻击逃逸。
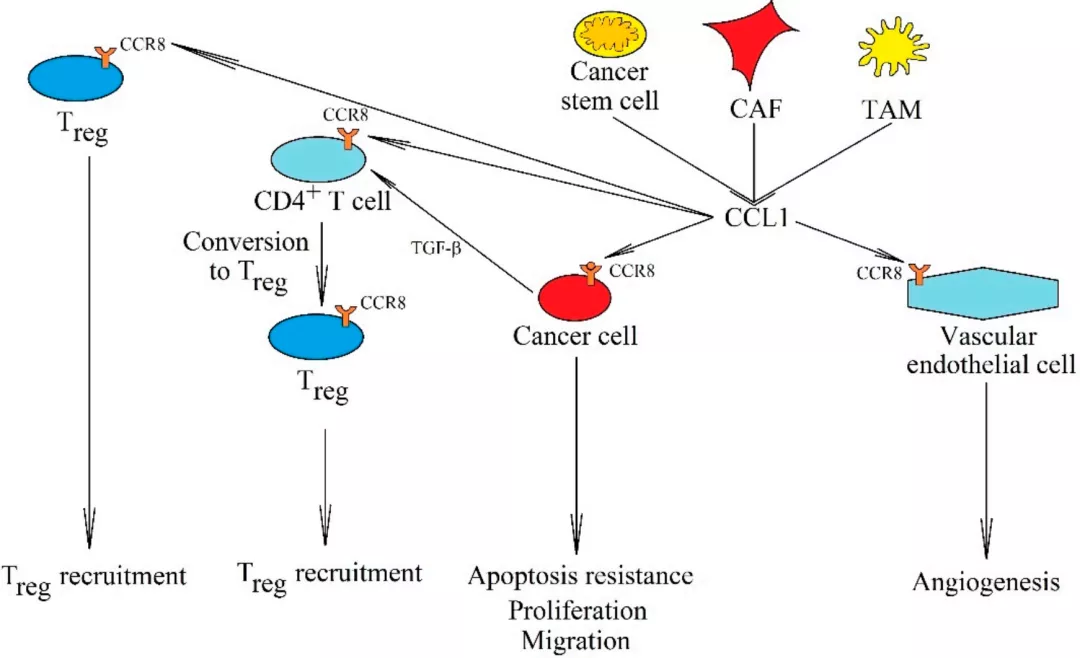
CCL1-CCR8信号通路的作用 [3]
CCR8因其在Treg中特异性表达而被工业界重视,靶向CCR8的疗法可以释放TME中已有免疫细胞的功能以及对其它疗法的协同增强作用,因此无论是单独还是联合给药都具有很好的潜力。
“
CCR8研发现状
今年2月,Surface Oncology公司从Vaccinex 获得SRF114的权益。SRF114是一种完全人类IgG1抗CCR8的单抗,能特异性地与人CCR8结合,并通过抗体依赖的细胞毒性效应(ADCC)诱导Treg破坏,同时保留外周Tregs。根据协议条款,Surface Oncology公司除支付研究经费外,还应支付技术使用费和许可费,并且Vaccinex将有资格获得开发里程碑付款和版权使用费。今年5月份,BMS启动了全球唯一一项CCR8单抗药的临床实验(BMS-986340)。除此之外,也有其他公司在CCR8上布局:
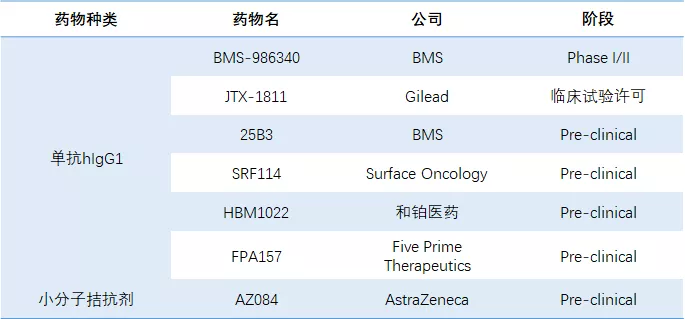
CCR8相关药物研发 [4]
靶向CCR8的药物急需在两个方向进行突破,一是解决肿瘤患者对PD-1/PD-L1等药物响应率低的问题。PD-1/PD-L1疗法虽取得了革命性的成功,但肿瘤组织中浸润的Treg会减弱这种疗效,有统计显示,针对NSCLC的几款单抗药的ORR仅在30%附近甚至不到 [5] 。二是CCR8在TME中更为详尽的作用机制。研究表明,敲除CCR8对Treg细胞的迁移能力和移植瘤生长没有明显的影响 [6] ,而当将CCR8抗体的Fc段改变为强ADCC结构(如去岩藻糖基化)时,小鼠移植瘤则被明显抑制,由此说明在设计CCR8抗体时可能要充分考虑不同结构区域的设计方法及设计重点 [7] 。
实体瘤领域的免疫检查点疗法PD-1/PD-L1等单抗药层出不穷,一直以来,研究者在降低肿瘤细胞浸润的Treg细胞数量和Treg免疫抑制效应上开展了大量工作。近来通过逆转Treg的抑制功能、干扰Treg代谢和切断趋化通路及药物联用均取得了比较理想的效果。当然,进一步有效区分肿瘤浸润Treg和正常组织中Treg细胞的转录水平差异,不断缩小肿瘤模型与肿瘤患者Treg细胞消除动力学差异,可为基于Treg细胞靶点的肿瘤免疫疗法提供更多的治疗依据。
综上,CCR8未来更有可能在双抗(如普米斯正开发的CTLA-4/CCR8双抗)以及联合用药(如与PD-1/PD-L1等单抗联用)上有更多布局,也有可能在Treg细胞功能逆转等方面进行切入,从无人问津到成为肿瘤免疫领域的新宠,靶向CCR8,正风起云涌时。
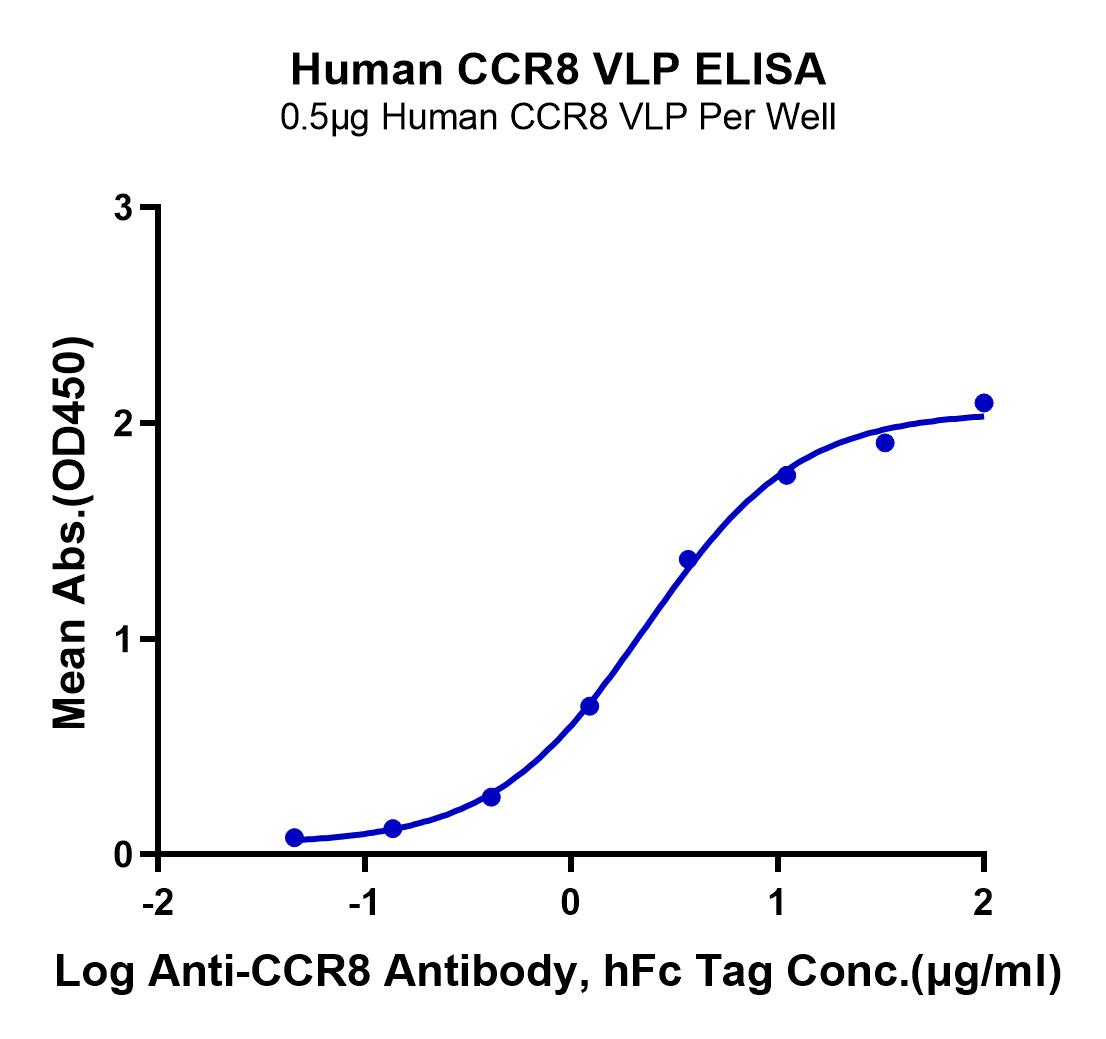
恺佧生物推出全新高活性全长跨膜CCR8蛋白,助力肿瘤免疫治疗!
质控数据:
上下滑动查看更多

 网站首页
网站首页




